第278回関東甲信越地方会 受賞者一覧(2025年12月20日開催)
第278回関東甲信越地方会 最優秀賞受賞演題(2025年12月20日開催)
Student Award
イバブラジン先行投与がHFrEF患者におけるGDMT最適化を促進する可能性:WET-HF2 レジストリ解析
安田 有輝(1)、長友 祐司(2)、内藤 朱美(2)、河合 茜(2)、合田 あゆみ(3)、河野 隆志(3)、野本 美智留(4)、北村 光信(5)、宮本 和享(6)、坂本 宗久(7)、樋口 聡(8)、庄司 聡(9)、白石 泰之(9)、香坂 俊(9)、足立 健(2)、吉川 勉(5)
(1)防衛医科大学校 医学科6年生
(2)防衛医科大学校 循環器内科
(3)杏林大学 循環器内科
(4)埼玉医科大学国際医療センター 心臓内科
(5)榊原記念病院 循環器内科
(6)済生会中央病院 循環器内科
(7)国立病院機構東京医療センター 循環器内科
(8)昭和医科大学 循環器内科
(9)慶應義塾大学医学部 循環器内科
【背景】
HFrEF患者において、Guideline-directed medical therapy (GDMT)の導入およびtitrationは予後改善に極めて重要である。しかし、低血圧や低心機能などの臨床的要因により、特に急性心不全入院後早期ではGDMTの導入・titrationが困難な症例が多く存在する。イバブラジンは洞結節HCNチャネル遮断薬であり、陰性変力作用を示さないという薬理学的特性を有し、第三相試験(SHIFT試験、J-SHIFT試験)では、有意な血圧低下を伴うことなく、プラセボと比して臨床アウトカムおよび左室駆出率(LVEF)を改善することが報告されている。(1)(2)これらの知見より、イバブラジンの先行投与は、その後のGDMT最適化を促進する可能性があると考えられる。
【目的】
多施設共同急性心不全レジストリWET-HF2のデータを用い、HFrEF患者(LVEF≤35%、洞調律、退院時心拍数≥75 bpm)に対するイバブラジン投与が、その後のGDMT titration、reverse remodeling(EF改善)、および臨床イベント発生に与える影響を検討する。
【方法】
WET-HF2レジストリより、急性心不全入院患者のうち、退院時イバブラジン投与患者(iva群, N=51)と適応を有するにもかかわらず投与されなかった非投与群(non-iva群、N=216)の計267例を解析対象とした。退院1年後のGDMT達成状況、LVEF、ならびに退院後2年間の臨床イベント(全死亡、心不全再入院)を比較した。
【結果】
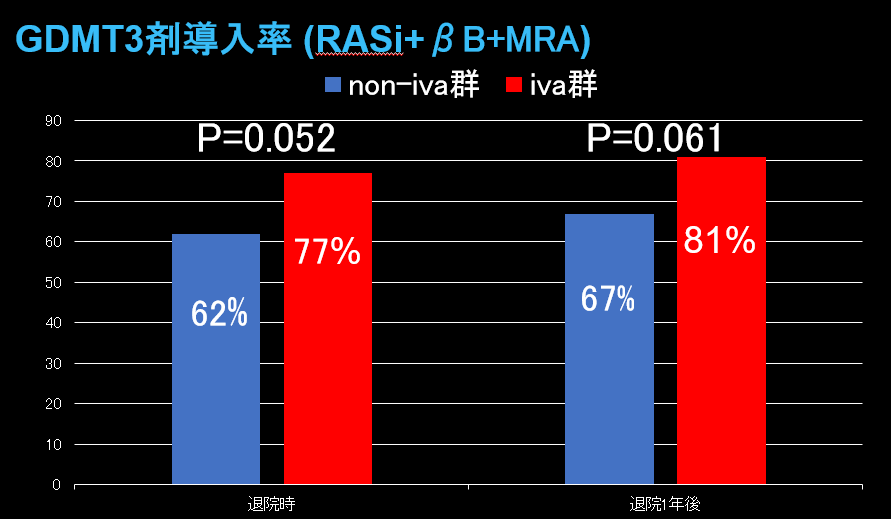
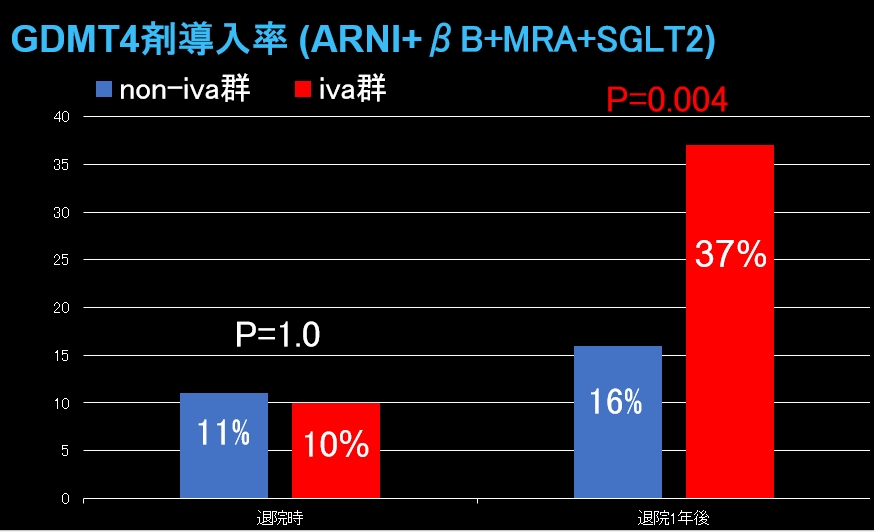
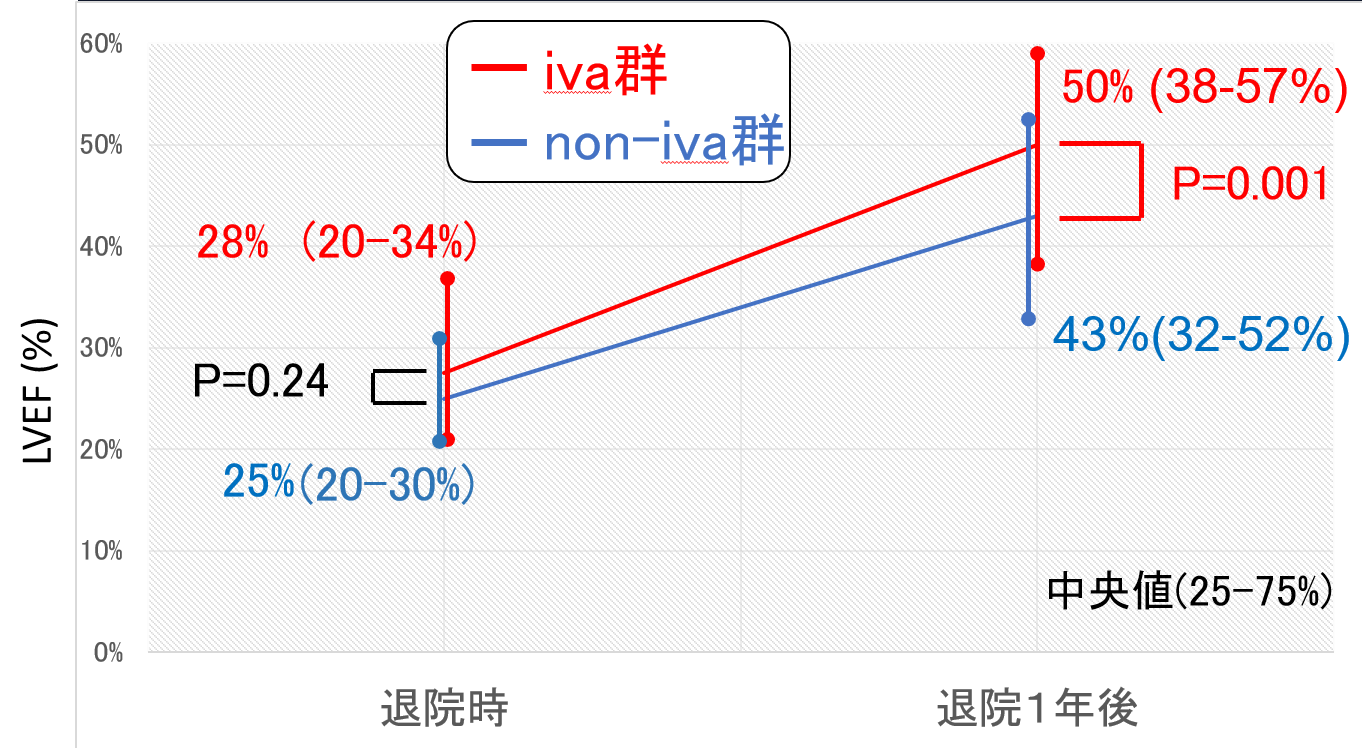
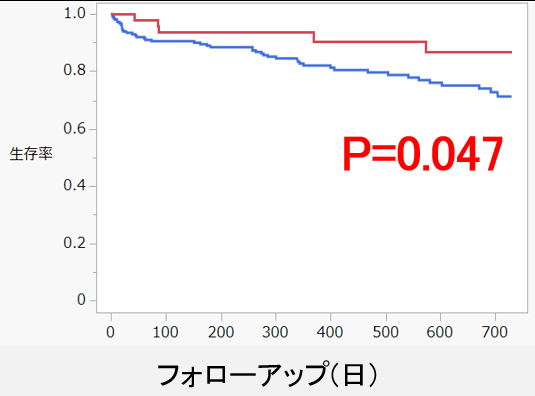
GDMT3剤導入率は退院時および退院1年後ともにiva群で高い傾向を示した。(図1)一方、退院1年後GDMT4剤導入率はiva群(37%)でnon-iva群(16%)より有意に高率であった(P=0.004、図2)。多変量解析において、退院時イバブラジン投与は退院1年後GDMT4剤導入の独立規定因子であった(OR 2.95、95% CI 1.34-6.47、P=0.008)。LVEFはiva群で退院1年後に50%まで改善を認め、non-iva群(43%)と比して有意に高値であった(P=0.001、図3)。退院後2年間の全死亡+心不全再入院複合エンドポイントは、iva群で有意に低率であった(P=0.047、図4)。
【考察】
本研究より、イバブラジンの先行投与はHFrEF患者におけるGDMT最適化を促進し、reverse remodelingおよび臨床イベント抑制に寄与する可能性が示唆された。本研究は中国からの先行研究の報告(3)と矛盾しないが、本研究ではARNIやSGLT2阻害薬を含む最新のGDMT titrationを検証できた点に新規性がある。
【結論】
イバブラジンはHFrEF患者におけるGDMT最適化を促進し、臨床予後改善に寄与する可能性が示唆された。これらの知見を確立するためには、より多くの症例を対象とした前向き研究が必要である。
【参考文献】
(1) Lancet 2010; 376:875-85
(2) Circ J 2019; 83: 2049 – 2060
(3) Clin Cardiol.2022;45:928-935
Resident Award
長期間頻脈誘発性心筋症と診断されていた抗ミトコンドリア抗体陽性心筋炎の一例
赤木舞1)、小林剛2)、川口直紀2)、江口実佑2)、須藤洸司2)、後藤剛顕2)、大森一平2)、齋藤惇平2)、朝比奈千沙2)、相沢聖子2)、山田亮太2)、出山順太郎2)、堀越健生2)、吉崎徹2)、渡邉陽介2)、植松学2)、中村和人2)、黒木健志2)、中村貴光2)、佐藤明2)
1) 山梨大学医学部附属病院 臨床研修センター 初期研修医1年目
2) 山梨大学医学部附属病院 循環器内科
【症例】
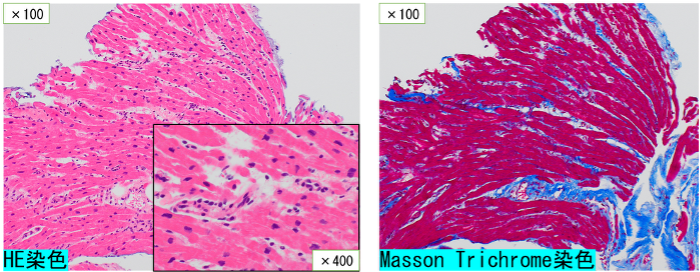
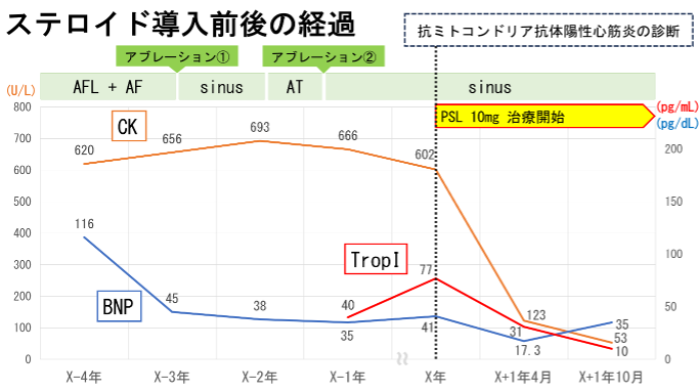
39歳女性。X-4年11月に労作時息切れ・下腿浮腫・全身倦怠感を自覚、心房粗動(AFL)による頻脈誘発性心筋症の疑いとして他院で薬物加療を開始された。当院へ紹介受診し、カルディオバージョンで洞調律化した。X-3年1月には心房細動(AF)を発症し、カテーテルアブレーション(CA)で洞調律化するも、X-2年6月に心房頻拍(AT)を発症し、2回目のCA施行し洞調律化した。X年には洞調律を維持しているにも関わらず心不全の悪化を認め、入院精査を受けた。血液検査にてCK 602U/L、トロポニンI 77.7pg/mLの上昇認め、経胸壁心エコー検査では収縮能はEF59%と保持されていたがE/e’19.6であり拡張障害を認めた。冠動脈造影は有意な狭窄なく、ForresterⅠ型、平均肺動脈圧は21mmHgであった。心臓MRIではT1mapping 1333msと正常で遅延造影は陰性であった。抗ミトコンドリアM2抗体陽性が判明し、改めて身体所見を確認すると四肢近位筋の筋力低下・腱反射低下および針筋電図で急性の筋原性変化を認めた。右室中隔の心筋生検を実施し、リンパ球浸潤と間質の浮腫・線維化を認め(図1)、抗ミトコンドリア抗体陽性心筋炎の診断に至った。プレドニゾロン内服加療を開始したところ、CKおよびトロポニンIの陰転化を認め、臨床症状の改善を認めた(図2)。現在はプレドニゾロンによる精神症状の出現があり、デキサメタゾンに変更して内服加療を継続し、循環器内科・神経内科外来にて経過観察している。
【考察】
抗ミトコンドリア抗体陽性心筋炎の有病率は100万人あたり3人と稀な疾患であり、初期症状は下肢筋力低下が多い(82%)。診断基準は①抗ミトコンドリアM2抗体が陽性、②筋障害の所見(筋力低下・CK上昇・針筋電図で筋原性変化など)、③生検で筋炎の所見、④その他の筋炎(皮膚筋炎・強皮症など)を否定、などを満たすものとすることが多い。また筋症状が軽微で心症状が前面に出ることがあり(約58.5%に心病変合併)、そのうち88%で頻脈性不整脈を認めたと報告されている。治療にはステロイド・免疫抑制薬が用いられるが確立していないのが現状である1)2)。
本症例では複数の上室性頻脈性不整脈に対してカテーテルアブレーションを行った後も持続する心機能障害を認めていた。改めて評価すると四肢近位筋を中心とする筋力低下と腱反射低下、遷延するCKの上昇、抗核抗体陽性を認め本疾患の診断に至った。診断後ステロイド治療を開始することでCKおよびトロポニンIが正常化し心機能の改善が見られた。
【結語】
診断に長期間を要した抗ミトコンドリア抗体陽性心筋炎の一例を経験した。頻脈誘発性心筋症と診断された中に本疾患が含まれていると推測され、頻脈性不整脈の原因として鑑別に挙げる必要がある。
【参考文献】
- 1)
- Maeda M, Kawahara T, Kubota A, et al. J Neurol Sci. 2024;467:123287.
- 2)
- Bujo S, Amiya E, Hashimoto Maeda M, et al. ESC Heart Fail. 2022;9(6):4112-4119.
Clinical Research Award
非ST上昇型急性冠症候群患者の長期予後と冠動脈CTで計測する血管周囲脂肪減衰指数との関係
左山耕大, 臼井英祐, 金地嘉久, 上野弘貴, 渡邉匠, 渡邊崇弘, 村上理子, 廣井駿太, 細川凱生, 角田恒和
土浦協同病院循環器内科
背景:ST上昇型急性心筋梗塞患者に比して非ST上昇型急性冠症候群(NSTE-ACS)患者の長期予後は不良であるが長期予後の予測因子は現在も検討途上である. FAI(fat attenuation index)は冠動脈CTから得られる冠動脈周囲の脂肪織濃度減衰指数で局所の炎症を反映する.1 近年は慢性冠症候群や非閉塞性冠動脈疾患でFAIが予後予測に非常に有用と報告されているがNSTE-ACS患者における既報はないため本研究において検討した. 2
手法:NSTE-ACSの診断にて当院で冠動脈CTを実施後に準緊急CAGが実施され責任病変が同定できPCIを実施された患者を対象とした. 心筋梗塞や冠血行再建既往を有する患者やCABGを要した患者, 維持透析患者, 1年以内にフォローアップが終了となった患者等は除外とした. Primary endpointは冠動脈CT施行後10年以内の全死亡及び非致死的心筋梗塞の複合主要心血管イベント(MACE)とした. FAIの解析手法は既報をもとに実施し冠動脈3枝の平均値をFAI-meanとして採用した. 3
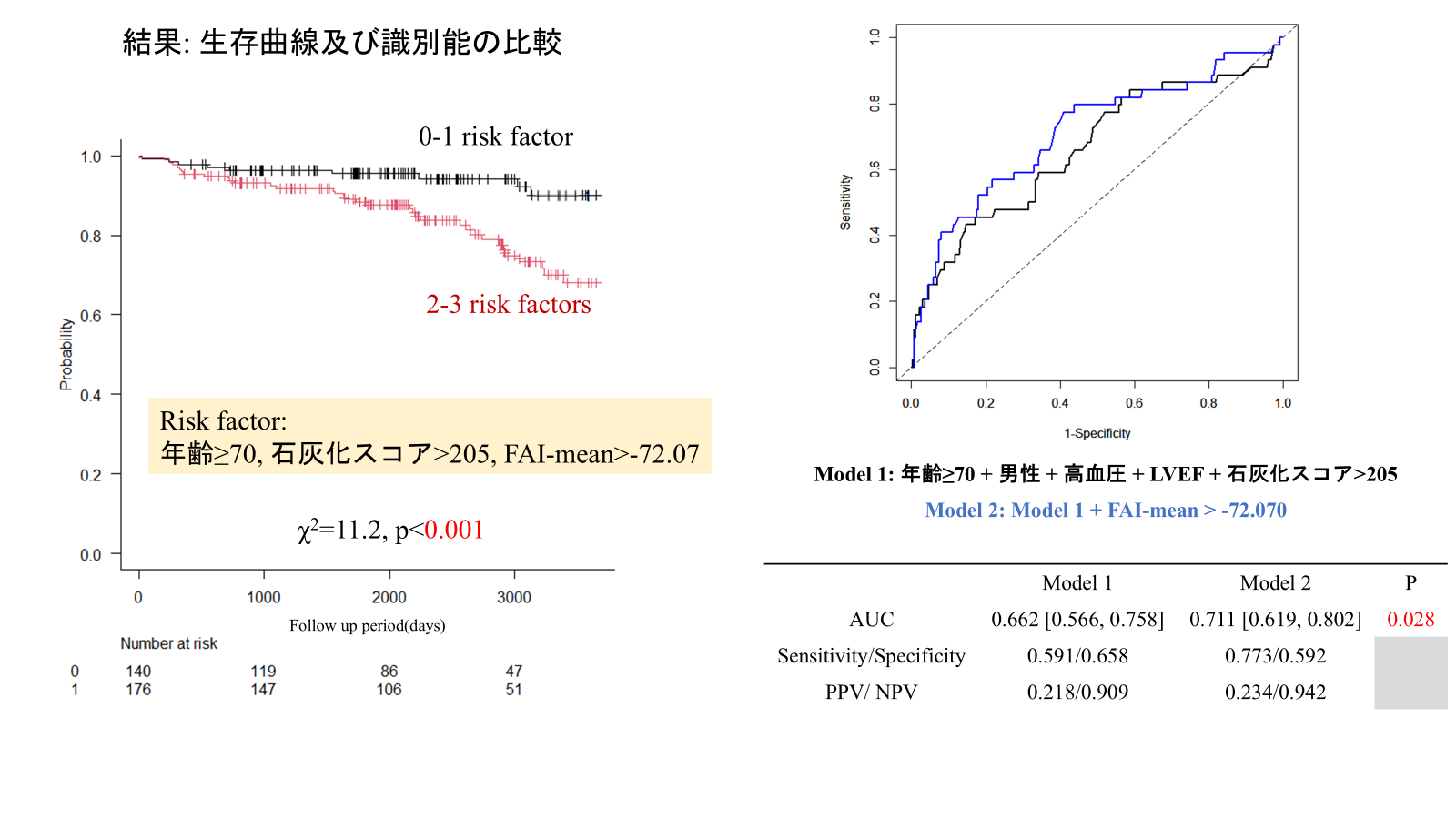
結果:316人が対象となり(平均年齢: 65.3±11.6歳, 男性: 78.2%), 中央値73.5ヵ月[50.5-106.5]の追跡期間中にMACEは44件(13.9%)発生した. MACE群は非MACE群に比して高齢で入院時のNT-pro BNPが高値であり, またGrace scoreや冠動脈石灰化スコア(CACS)に加えてFAI-meanが高値であった. 多変量Cox比例ハザード解析では年齢(HR: 1.04, p=0.023), CACS(HR: 1.00, P=0.003), FAI-mean(HR: 1.05, p=0.042)が独立したMACEの予測因子であり, 各々のcut-off値は70歳, 205.2, -72.07HUであった. これらのリスク因子を複数有する患者はそうでない患者に比して有意に予後が不良であり, また年齢や性別等からなるリスクモデルにFAI-mean>-72.07HUを付加することで予後予測能が有意に改善した. (図参照)
考察:本研究はNSTE-ACS患者においてCAG/PCI前の冠動脈CTにて測定されるFAIが長期予後予測に有用であることを示した初めての報告になる. FAIは血中のCRP値や白血球値とは相関せず, 全身的な炎症指数とはまた別の局所の微細な炎症を反映すると考えられる. FAI高値と冠動脈プラークの不安定性や冠血流低下との関連は報告されているが, 本研究においてNSTE-ACSの責任血管のFAIは予後と関連しなかったことからPCIによっても解消されない残余リスクであると考えられ, より積極的な介入を要する高リスク患者を同定する一助になると期待される. 一方でFAIとMACEとの直接的な関連は現状で不明であり, 更にFAI高値の患者に対する臨床的な介入手段も定まっていない. 単施設の観察研究である点やvalidation cohortがない等のlimitationもあり, より大規模な前向き研究での追証が待たれる.
結論:NSTE-ACS患者においてPCI前の冠動脈CTで評価されるFAIは, 冠血行再建後の長期予後の独立した予測因子である.
- 1.
- J Kwiecinski, et al. JACC Cardiovasc Imaging. 2019 Oct;12(10):2000-2010.
- 2.
- E K Oikonomou, et al. Lancet. 2018 Sep 15;392(10151):929-939.
- 3.
- T Sugiyama, et al. J Am Heart Assoc. 2020 Aug 4;9(15):e016202.
Case Report Award
KLHL24 の機能獲得型病的バリアントによって単純型表皮水疱症と拡張型心筋症を発症した若年男性の一例
瀬戸口 仁美1, 八木 宏樹1, 田中 亮1, 蛭間 貴司1, 井上 峻輔1, 阿部 浩幸2, 野村 征太郎1, 石田 純一1, 網谷 英介1, 波多野 将1, 小室 一成3, 武田 憲彦1
東京大学医学部附属病院 循環器内科1, 病理部2
国際医療福祉大学3
【症例】
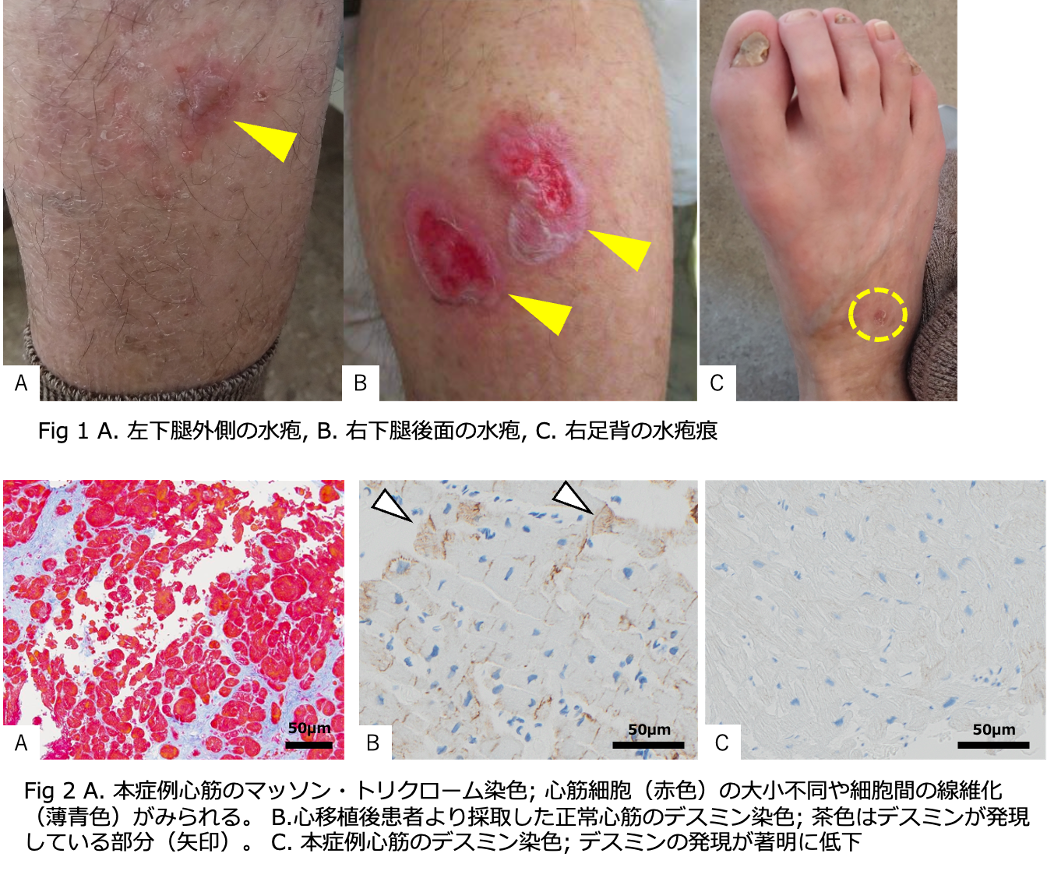
生後より表皮水疱症の外用治療を継続されてきた22歳男性。表皮水疱症は軽症のため病型の確定診断はされていなかった。心血管疾患の既往歴や家族歴はなく、水疱症の家族歴もない。X-1年より労作時息切れや易疲労感を自覚していた。X年6月に失神し、前医の心エコー検査で低左心機能を指摘され、当院へ紹介された。両下腿や足背の皮膚に水疱を認めたが、体幹部には認めなかった(Fig 1 A, B, C)。心エコー検査にて左室駆出率(EF) 17%と低下(HFrEF)し、左室拡大を認めた。心臓MRI検査では左室全周性に遅延造影を、MIBG心筋シンチグラフィにて高度の集積低下を認め、拡張型心筋症(DCM)と診断した。心保護薬の導入・増量を行うもリバースリモデリングが得られず、BNP高値が持続した。致死的不整脈の予防に対するデバイス治療や、将来的な補助人工心臓、移植医療等が考慮されたが、皮膚脆弱性の観点から侵襲的治療に対する耐容能の評価が必要と考え、全エクソン解析を実施した。その結果、単純型表皮水疱症(EBS)の原因遺伝子として知られるKLHL24 の開始コドンにヘテロ接合型ミスセンス変異(c.1A>G, p.Met1Val)が検出された。さらに心筋病理像では心筋細胞間の線維化や大小豊富といったDCMに矛盾のない所見と(Fig 2 A)、正常心筋と比較して著しいデスミンの発現低下を認めた(Fig 2 B, C)。
【考察】
KLHL24 がコードするKLHL24 タンパクは、骨格筋・肺・心臓の順に多く発現し、中間径フィラメントの主要な構成成分であるケラチン14(K14)やデスミンを安定化して細胞を機械的ストレスから保護する作用を担っているため、皮膚疾患以外に心筋症への関与も示唆されている1。先天性表皮水疱症は、水疱の発生部位の違いにより単純型、接合部型、栄養障害型等に分類される。表皮内に水疱を生じるEBSは比較的予後良好で、本症例のように四肢のみに水疱を生じる限局型の他、中等度汎発型、重症汎発型に分類される。KLHL24 は変異部位によって心筋症の病型が異なることが報告されている2。N末端開始コドンのヘテロ接合性変異では、自己ユビキチン化されにくい短縮タンパク(ΔN28、ΔN29)が生じることでK14やデスミンが過剰分解され(機能獲得型)、EBSやDCMを発症する。EBSは幼少時から必発だが、DCMの発症年齢は幅広く、年齢依存や不完全浸透の可能性が示唆されている3,4。一方で、KLHL24 内部領域のホモ接合型変異では、KLHL24 タンパクの産生低下・機能低下により心筋でデスミンが分解されず蓄積し(機能喪失型)、肥大型心筋症(HCM)を発症する。心筋ではデスミンの量が厳密に制御されており、心筋のデスミン蓄積が増加することでHCMを発症するが、皮膚ではケラチンが非常に大量に発現しているため多少分解が低下しても構造破綻まで至らないとされている。以上から、本症例はKLHL24 の機能獲得型病的変異によってEBSとDCMを発症したとの結論に至った。現時点で心筋のリバースリモデリングは得られていないが、EBSの病型は限局型であり、侵襲的治療への選択肢を除外する必要はないと考え、心不全の治療戦略をより明確にすることが出来た。以上から、皮膚脆弱性疾患を有する若年 HFrEF 患者の治療戦略をより詳細に検討する上で、遺伝学的検査が有用な可能性があると考えられた。
【参考文献】
- 1.
- Lin Z, Li S, Feng C, Yang S, Wang H, Ma D, Zhang J, Gou M, Bu D, Zhang T, et al. Stabilizing mutations of KLHL24 ubiquitin ligase cause loss of keratin 14 and human skin fragility. Nat Genet. 2016;48:1508-1516. doi: 10.1038/ng.3701
- 2.
- Vermeer M, Al-Shinnag M, Sillje HHW, Gaytan AE, Murrell DF, McGaughran J, Melbourne W, Cowan T, van den Akker PC, van Spaendonck-Zwarts KY, et al. A translation re-initiation variant in KLHL24 also causes epidermolysis bullosa simplex and dilated cardiomyopathy via intermediate filament degradation. Br J Dermatol. 2022;187:1045-1048. doi: 10.1111/bjd.21832
- 3.
- Schwieger-Briel A, Fuentes I, Castiglia D, Barbato A, Greutmann M, Leppert J, Duchatelet S, Hovnanian A, Burattini S, Yubero MJ, et al. Epidermolysis Bullosa Simplex with KLHL24 Mutations Is Associated with Dilated Cardiomyopathy. J Invest Dermatol. 2019;139:244-249. doi: 10.1016/j.jid.2018.07.022
- 4.
- Vermeer M, Arevalo Gomez KF, Hoes MF, Tromp J, Verdonschot JAJ, Henkens M, Sillje HHW, Bolling MC, van der Meer P. Clinical Outcome in KLHL24 Cardiomyopathy. Circ Genom Precis Med. 2023:e003998. doi: 10.1161/CIRCGEN.122.003998