第269回関東甲信越地方会 受賞演題一覧(2023年9月2日開催)
第269回関東甲信越地方会 最優秀賞受賞演題(2023年9月2日開催)
Student Award
抗凝固療法中に心原性脳塞栓症を5度発症し、左心耳閉鎖術後にも抗凝固療法を継続した永続性心房細動の1例
田中 絵理1)、小川 孝二郎2)、山﨑 浩2)、南 健太郎2)、中務 智文2)、町野 智子2)、石津 智子2)、
家田 真樹3)
1)筑波大学 医学群医学類
2)筑波大学 医学医療系 循環器内科
3)慶應義塾大学 医学部 循環器内科
«背景»
心房細動患者において、抗凝固療法中にも関わらず血栓塞栓症を発症し、抗凝固薬のみでは十分な予防効果が得られない例をしばしば経験する。左心耳閉鎖術は、こうした例での塞栓症予防効果が期待されているが、十分な検証はされていない。
«症例»
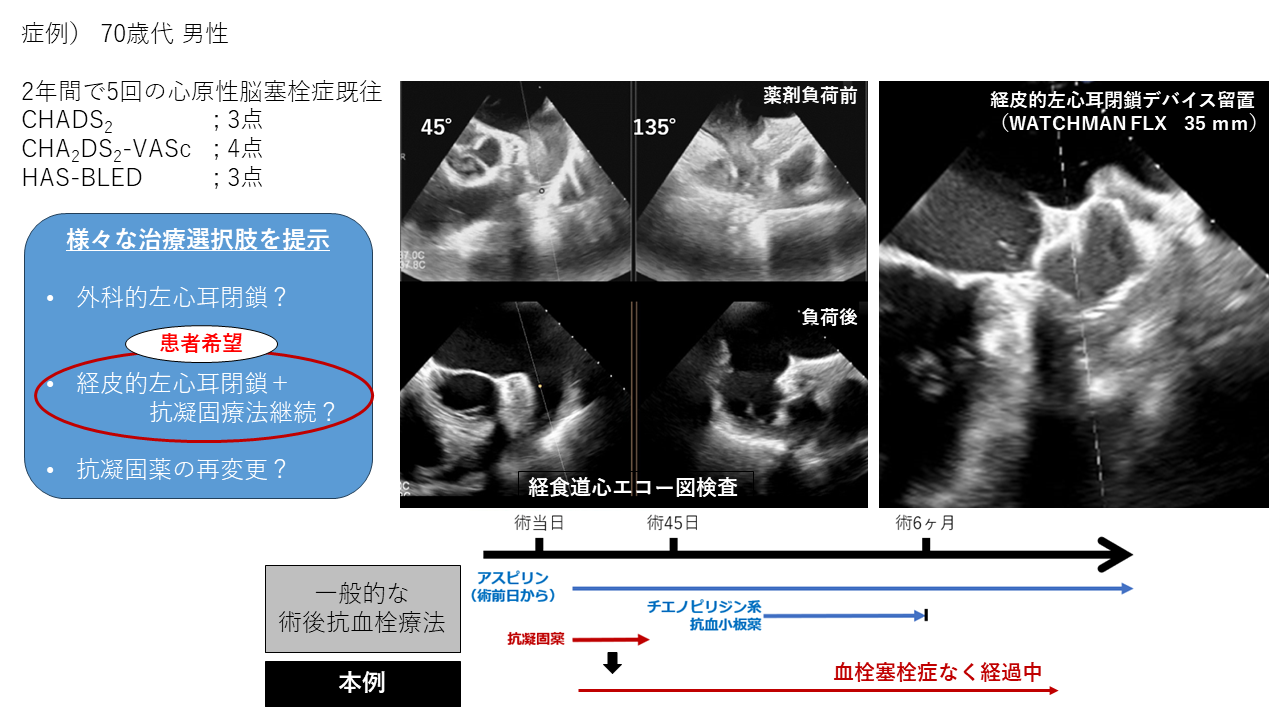
高血圧および抗凝固療法中に2年間で5度脳塞栓症の既往をもつ、永続性心房細動の70歳代男性(CHADS2スコア3点)。有意な血栓性素因を認めず、頭部画像所見からも心原性塞栓と考えられた。経食道心エコー図検査で左心耳内に高度のモヤモヤエコーが確認された。
外科的左心耳切除術も含め治療方針が検討された。HAS-BLEDスコアは3点だが、明らかな出血性合併症の既往なく、抗凝固療法に対する忍容性があると考えた。経皮的左心耳閉鎖術を施行した上で、術後抗凝固薬を継続する方針を示し患者も希望された。左心耳閉鎖デバイス(WATCHMAN FLX 35mm)が留置された。抗凝固薬を術後45日目以降も継続して経過観察とした。術後半年来、血栓塞栓症の再発なく経過している。
«考察»
経皮的左心耳閉鎖術後の抗血栓療法において、抗凝固薬の中止(抗血小板剤のみに変更)後が、デバイス血栓症を生じる好発期である。1) 抗凝固療法中に血栓塞栓症を発症した場合、年間再発率が5-8% と高く、抗凝固薬の種類を変更しても再発抑制が困難とされ、血栓症の高リスク因子である。2)3) こうした例は、一般的な経皮的左心耳閉鎖術とその後の抗血栓療法、即ち術後経過で抗凝固療法を終了した場合、長期的な抗凝固療法継続に比べて、著しく血栓塞栓症の発症率が高いとされる。4)
抗凝固療法に対する忍容性がある場合に限るが、経皮的左心耳閉鎖術後に一般的な投与期間以降も抗凝固薬の投与を継続することは、血栓塞栓症の高リスク例において1つの治療選択肢と考えられる。継続期間や抗凝固薬の投与量に関しては、さらなる評価を要すると考えられる。
«結語»
抗凝固療法中に血栓塞栓症を2年で5回生じた既往のある心房細動患者に、経皮的左心耳閉鎖術を行い、術後45日以降も抗凝固療法を継続した。術後半年は血栓塞栓症を発症することなく経過した。血栓症や出血のリスクに応じた経皮的左心耳閉鎖術後の最適な抗血栓療法については、今後も議論を要する。
«参考文献»
- 1)
- Dukkipati SR, Kar S, Holmes DR, et al. Device-Related Thrombus After Left Atrial Appendage Closure: Incidence, Predictors, and Outcomes. Circulation. 2018;138:874-885.
- 2)
- Tanaka K, Koga M, Lee KJ, et.al. Atrial fibrillation-associated ischemic stroke patients with prior anticoagulation have higher risk for recurrent stroke. Stroke. 2020;51:1150-1157.
- 3)
- Seiffge DJ, De Marchis GM, Koga M, et.al. Ischemic stroke despite oral anticoagulant therapy in patients with atrial fibrillation. Ann Neurol. 2020;87:677-687.
- 4)
- Pracoń R, Zieliński K, Bangalore S, et al.Residual stroke risk after left atrial appendage closure in patients with prior oral anticoagulation failure.Int J Cardiol. 2022;354:17-21.
Resident Award
スマートウォッチでは検出できないもののホルター心電図で再発を検知した発作性心房細動の1例
朝倉 来実1)、毛利 崇人2)、野々口 紀子2)、池脇 宏嗣2)、勝目 有美2)、田代 身佳2)、星田 京子2)、
冨樫 郁子2)、上田 明子2)、松尾 征一郎2)、佐藤 俊明2)、副島 京子2)
1)杏林大学医学部付属病院 総合研修センター
2)杏林大学医学部付属病院 循環器内科
【緒言】 近年、スマートフォンやスマートウォッチなどのウェアラブルデバイスを用いた脈波計測や心電図記録が可能になっている。自ら行えて簡便であり、ホルター心電図などの従来の検査に代わる方法として期待されている。Apple Watch®は光電式容積脈波記録法(photoplethysmography: PPG)による脈拍数のモニターと心電図記録が可能である。Apple watch®の背面に電極1、側面のDigital Crownに電極2が内蔵されており、Apple watch®を左手首に装着してDigital Crownに右手の指をのせることでⅠ誘導に近似した心電図を記録できる。
【症例】 59歳男性。胸部違和感を自覚し、Apple watch®から「不規則な心拍」の通知があり近医を受診した。ホルター心電図では有意な所見を認めず紹介受診となった。12誘導心電図は洞調律、心エコーでは左室壁運は良好で弁膜症も認めなかった。心電図記録を指導し、「不規則な心拍」の通知時のApple watch®心電図より心房細動(atrial fibrillation; AF)と診断し、カテーテルアブレーションを施行した。術後は脈の欠落の自覚はあったが「不規則な心拍」の通知はなく、有症状時のApple watch®の心電図は心室期外収縮であった。術後6ヶ月にホルター心電図を施行した。Apple watch®も終日装着していたが「不規則な心拍」の通知はなかった。ホルター心電図は洞調律で経過したが就寝中にAFを認め、約10分間で停止した。その後も数分のAFが繰り返し記録されたが、Apple watch®からの通知はなかった。このように本症例ではApple watch®では検出できないAFをホルター心電図でとらえた。
【考察】
本邦でのパーソナルデバイスの普及は顕著で今後さらに不整脈の検知にウェアラブルデバイスが使用されると考えられる。ウェアラブルデバイスのPPGを用いたAF検出は種々の報告で感度90%以上と良好である。Apple watch®では安静時は2時間に1回行う1分間の脈波計測からリズム判定を行い、脈の不整を検知した場合は15分毎に計測を行って連続6回の計測のうち5回で脈の不整と判断した場合に<不規則な心拍>の通知を出す。このアルゴリズムで不規則な心拍通知を受けた症例のうち、34%がのちに心電図でAFと診断されている。一方で常時測定ではないため診断能に限界があり、本例ではアブレーション後にAF持続時間が短くなり検出に至らなかったと考えられる。
また、Apple watch®の心電図計測アプリによるAF判定の精度は良好であるが、波形はⅠ誘導に近似したものとなるため、P/QRS波が小さいと判定が困難な場合がある。しかし本体背面を胸部にあてた状態でデジタルクラウンに触れるなど、装着部位を変えることで肢誘導・胸部誘導に近似した記録が可能との報告もある。
有症状時に患者自身が記録できることで、多彩な情報を得ることができる。
【結語】 Apple Watch®の脈拍評価による不整脈の検出感度は高いが持続的モニタリングではなく、短時間持続の不整脈ではアラートが出にくいという特性を理解して使用する必要がある。

Clinical Research Award
血行再建困難な重症虚血肢(CLTI)に対するバルーン拡張術のみによる経皮的deep venous arterialization(pDVA)の検討
高木 友誠、宮本 明、岡田 拓也、久原 亮二、福田 正浩、山内 靖隆
【背景】
包括的高度慢性下肢虚血(CLTI)患者において、desert footのような重症足関節以下動脈(BTA)病変で内科的・外科的血行再建が困難、もしくは血行再建術不成功例では、大切断の危機に直面しており、no-option CLTIと呼ばれる状況である。近年、no-option CLTI例に対して経皮的深部静脈の動脈化(Percutaneous deep venous arterialization; pDVA)が有効であることが報告されているが、本邦では、pDVA専用デバイスであるLimFlowおよび膝下動脈病変へのステント留置は未承認である。
【目的】
血行再建困難な重症BTA病変を有するCLTI症例に対して,従来のバルーン血管形成術を用いたpDVAの有効性を検討した。
【方法】
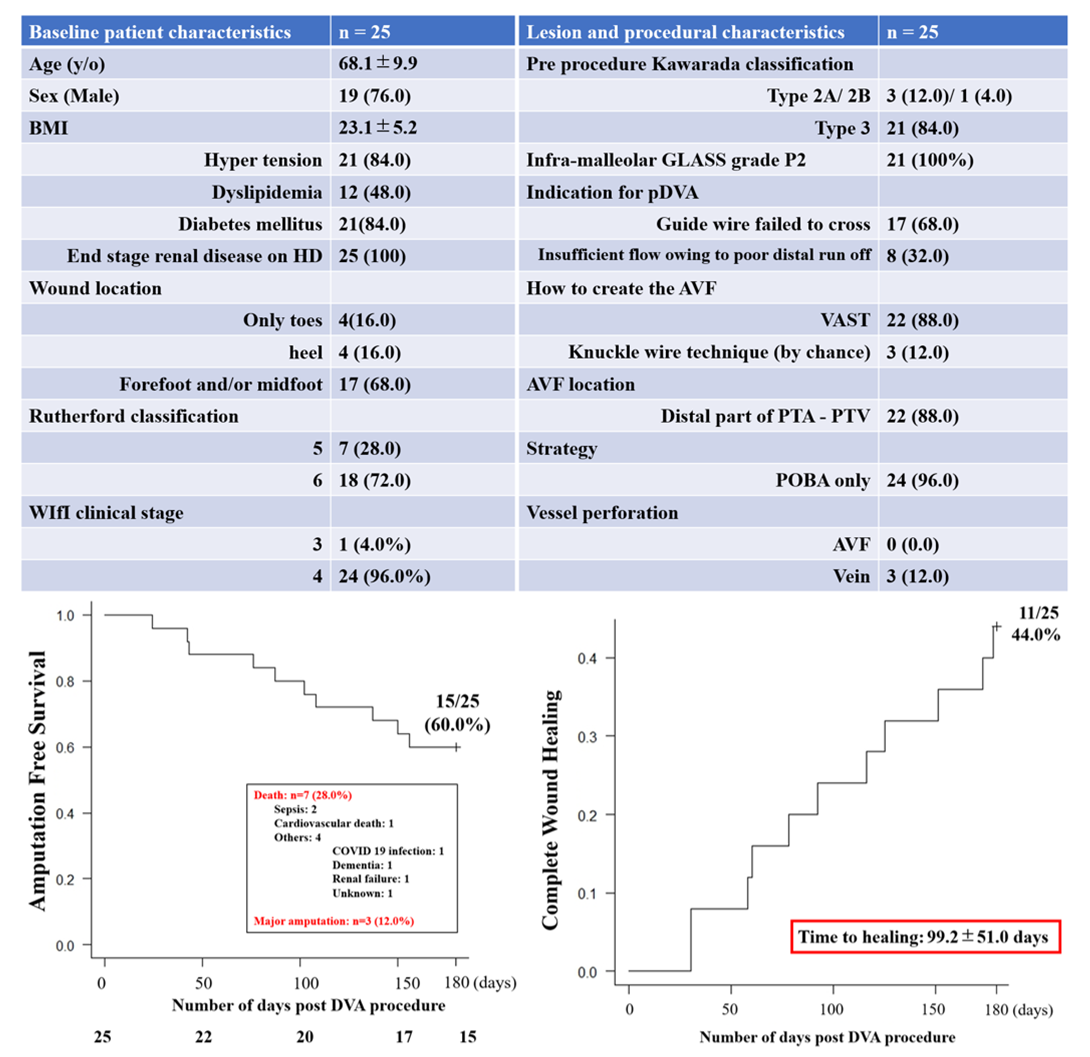
2021年5月から2022年11月までの期間に、当院にてバルーン拡張術によるpDVAを実施した連続25肢21例を対象とした。手技手順としては、足関節部でバルーン拡張した脛骨動脈と足部静脈をVAST(Venous Arterialization Simplified Technique)にて交通させて動静脈瘻(AVF)を造設し、脛骨動脈からAVFを介して足部静脈までガイドワイヤーを通過させ、足部静脈から脛骨動脈までバルーン拡張することでpDVAを作成した。尚、通常のバルーンで静脈弁破壊が不十分な場合は、カッティングバルーンを使用した。主要評価項目は、pDVA形成6か月後の大切断回避生存率(Amputation-free survival: AFS)とし、二次評価項目はpDVA形成6か月後の完全創傷治癒率(Complete wound healing: CWH)とした。
【結果】
患者・病変背景は、平均年齢68.1±9.9歳、男性76.0%、糖尿病 84.0%、維持透析100%、Rutherford分類6 72.0%、 WIfI clinical stage4 96.0%で、84.0%で足関節以下動脈がすべて閉塞(Kawarada classification type 3)していた。当院における初回例は外科的カットダウンにて静脈アクセスの確保を試み、DVA形成後に同部位から持続性出血をきたしたことからcovered stentを用いてbail outとした。
その後の24肢(96.0%)ではすべて経皮的に実施され、バルーン拡張術のみでDVAが形成された。22肢(88.0%)でVASTを用いて遠位後脛骨動脈─静脈にてAVF作成が行われ、18肢(72.0%)で足底静脈弓まで良好な造影所見がえられた。AVF部からの出血はみられなかったが、3肢(12.0%)で足底静脈の穿孔をきたした。DVA形成6か月後のAFSは60.0%、CWHは44.0%であった。
【結論】
結論:バルーン拡張術のみによるpDVAは、血行再建困難なCLTIに対する治療法として期待できる。
Case Report Award
家系解析が原因遺伝子同定に有用であったMYLK変異による遺伝性胸部大動脈解離症の一例
西條 大悟1)、八木 宏樹1)、2)、秋山 奈々3)、武田 憲文1)、2)、安藤 政彦2)、4)、山内 治雄2)、4)、
小室 一成5)、6)
1)東京大学医学部附属病院 循環器内科
2)東京大学医学部附属病院 マルファン症候群センター
3)東京大学医学部附属病院 ゲノム診療部
4)東京大学医学部附属病院 心臓外科
5)東京大学大学院 医学系研究科
6)国際医療福祉大学
【症例】生来健康な33歳男性。X年胸背部痛が出現し、前医にて胸膜炎が疑われ入院加療となったが、退院後も労作時呼吸困難や胸痛を自覚していた。3ヶ月後、同院にて心エコーを施行したところ重症大動脈弁閉鎖不全症および上行大動脈内のflapを認め、造影CTでStanford A型大動脈解離と診断され、当院紹介となった(Fig 1)。手術適応と判断され、自己弁温存大動脈基部置換術及び大動脈弁形成術を施行し、術後1ヵ月で独歩退院となった。結合織疾患に特徴的な身体所見を認めなかったが、既往のない若年例であったため、遺伝的要因を疑い、今後の管理に活かすべく大動脈遺伝子パネル検査を施行したところ、FBN1 (c.365G>A, p.Arg122His)とMYLK (c.4819G>A, p.Gly1607Ser)の2つのバリアントが検出された。FBN1バリアントは既報でVUS(variant of uncertain significance)と評価され、一方でMYLKは新規バリアントであった。どちらがより病態に寄与しているか正確な評価を行うため、十分な遺伝カウンセリングの後、追加で両親に対して家系解析を行った。両親ともにMarfan症候群様の身体所見はなく、心エコーでも大動脈弁輪拡張症は認めなかった。家系解析の結果、母親に発端者と同様のFBN1バリアントを認め、MYLKバリアントは発端者のde novoバリアントと判明した(Fig 2)。米国臨床遺伝・ゲノム学会ガイドライン1)に基づき、MYLKバリアントをpathogenicと判断した。
【考察】胸部大動脈解離の中には、単一遺伝子異常で発症するものがあり遺伝性胸部大動脈解離症と言われる。その中でも非症候群性では特徴的な身体所見を欠くため、大動脈解離を発症し初めて診断に至ることが多い2)。FBN1、MYLKいずれも非症候群性の原因となることが知られ、本例での正確な評価のため家系解析が重要な役割を果たした。MYLKの病的バリアントは報告数が少なく、また、重篤な表現型を呈することが多いため、今回病原性の評価が行えたことは非常に大きな意義があると考えられた。また、複数バリアントに対し適切な評価を行い、正確な情報を伝えることで患者家族の病態の受容につなげることができた。
【結語】本例のように候補遺伝子から複数のバリアントが同定された場合、原因遺伝子特定のためのアプローチとして、家系解析が重要である。
【参考文献】
- Richards S, et al. ACMG Laboratory Quality Assurance Committee. Standards and guidelines for the interpretation of sequence variants: A joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genetics in Medicine. 2015; 17(5): 405–424.
- Regalado ES, et al. Comparative Risks of Initial Aortic Events Associated With Genetic Thoracic Aortic Disease. J Am Coll Cardiol. 2022; 80: 857-869.
Figure 1

Figure 2



