第264回関東甲信越地方会 受賞演題一覧(2022年5月30日~6月4日開催)
第264回関東甲信越地方会 最優秀賞受賞演題(2022年5月30日~6月4日開催)
Student Award
糖尿病性心筋症の成因における膵由来ペプチドホルモンが及ぼす影響の検討
酒井力輝1)、前嶋康浩2)、中釜瞬2)、笹野哲郎2)
1)東京医科歯科大学医学部医学科5年
2)東京医科歯科大学病院 循環器内科
【背景】
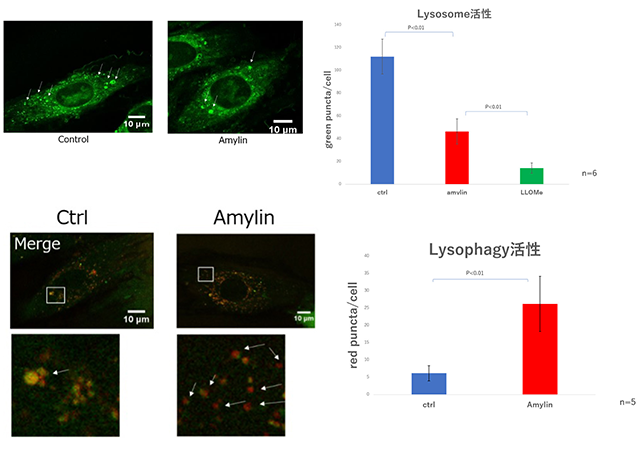
糖尿病患者に発症する心筋障害のうち、虚血心疾患などの明らかな基礎疾患を有さない疾患群である糖尿病性心筋症の機序は未解明な部分が多い。膵由来ペプチドホルモンであるアミリンはアミロイド線維を形成することや、リソソーム膜を損傷することで細胞毒性を発揮することが知られているため、アミリンが糖尿病性心筋症の発症に関与している可能性が示唆されている。
【目的】
本研究では、アミリンが心筋細胞に与える影響をin vitroで評価し、糖尿病性心筋症への関与を検討することを目的とした。
【方法】
ラット由来心筋細胞株のH9c2細胞におけるリソソーム活性にアミリンが及ぼす影響を定量的に評価した。また、損傷したリソソームの選択的オートファジーであるリソファジーをモニタリングする実験系を作成した上でアミリン投与がリソファジー活性に及ぼす影響を評価した。さらに、アミリンがマクロオートファジーの活性に及ぼす影響をウェスタンブロット法により評価した。そして、アミリンが細胞の生存性に及ぼす影響を評価するために細胞生存率の測定を行った。
【結果】
H9c2細胞内のリソソームはアミリン投与によって傷害されることを見いだした。また、アミリンを投与するとH9c2細胞におけるリソファジー活性も上昇することが明らかとなった。その一方、アミリン投与によってマクロオートファジーの活性は抑制されることを観察した。細胞生存率については、アミリン投与によって用量依存性に低下することを見いだした。
【考察】
本研究を通して、アミリンにより傷害を受けたH9c2細胞内のリソソームは、リソファジーが賦活化されることによって分解処理されていることが示唆される結果を得た。一方、マクロオートファジーがアミリン投与によって抑制されていたことについては、アミリンによりリソソームが傷害されてその絶対数が減少してしまった結果、マクロオートファジーが抑制されてしまったものと考えられる。また、アミリン投与によりH9c2細胞の生存率が低下してしまっていたが、これはリソソームが傷害された結果としてリソソーム内の消化酵素が細胞質に飛び出したことや、オートファジーが抑制されたことで細胞内ストレスが増大したことが原因となっている可能性があると考えられる。
【結論】
本研究の結果、アミリンの有するリソソーム傷害作用やオートファジー抑制作用により心筋細胞毒性が生じる可能性を見いだしたが、その一方でリソファジーが賦活化されることでダメージを受けたリソソームが処理されることにより心筋細胞の機能を保つシステム機が存在する可能性を見いだすこともできた。
Resident Award
非侵襲的低体温療法中に発症した難治性心室細動の一例
磯部いの八、金古 善明、藍原 和史、藤井 孝成、谷内 亮太、佐野 幸恵、天内 士郎、
石橋 洋平、長坂 崇司、高間 典明、小板橋紀通、石井 秀樹
群馬大学医学部付属病院 循環器内科
【症例】
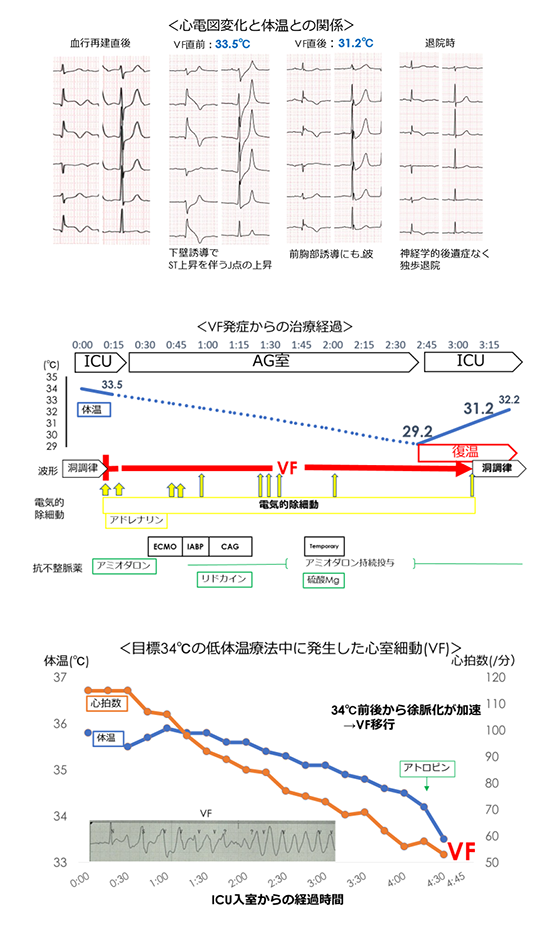
症例は70歳代男性。20××年1月、心肺停止後蘇生後に当院に救急搬送された。冠動脈造影検査(CAG)で右冠動脈#2に100%閉塞を認めため、緊急PCI施行しTIMI3 Flowを得た。JCS3桁の意識障害が残存していたため、非侵襲的な低体温療法装置を用いて目標体温34℃での低体温療法を施行したところ、膀胱温34℃前後で急に徐脈が進行し心室細動(VF)へ移行した。電気的除細動(DC)を2回、アドレナリン・アミオダロンの投与を行い一度はROSCしたものの、直後にVFが再燃した。血管造影室へ移動してECMO、IABPを挿入し、ステント内血栓症を疑って緊急でCAGを行ったが有意狭窄は認めなかった。継続するVFに対してDCを7回、リドカイン、硫酸マグネシウムを投与したがVFは停止しなかった。その後、膀胱温29.2℃であることが判明し、31.2℃まで復温して再度DCを行うと、VFは停止し洞調律に復帰した。その後は経過中にVFの再燃はみられず、目立った神経学的後遺症なく独歩で退院した。
VF直前の12誘導心電図ではⅡ、Ⅲ、aVFでST上昇を伴うJ波を認めており、VF直後には下壁誘導に加えて前胸部誘導でもJ波を認めた。J波は低体温療法終了に伴って消失し、退院時にも認めなかった。
【考察】
低体温療法中にJ波(オズボーン波)が出現する頻度は30%前後との報告があるが、VFが発生する頻度は非常に低い(3%未満)とされている。本症例は低体温時に広範囲の誘導でオズボーン波が出現したことが特徴的だった。VFに対して抗不整脈薬は無効で電気的除細動にも易再発性であったが、復温がVFの抑制のために有効だった。
Clinical Research Award
経カテーテル的人工弁におけるエコー圧較差の検証:LAPLACE-TAVIレジストリデータより
山崎 智永実1)、樋口 亮介1)、萩谷 健一1)、佐地 真育1)、高見澤 格1)、七里 守1)、井口 信雄1)、
高山 守正1)、清水 篤2)、清水 淳3)、土井 信一郎4)、岡崎 真也4)、田村 晴俊5)、佐藤 圭6)、
横山 公章7)、大西 隆行8)、桃原 哲也8)、高梨 秀一郎9)
1)榊原記念病院 循環器内科 2)榊原記念病院 心臓血管外科
3)榊原記念病院 麻酔科 4)順天堂大学附属順天堂医院 循環器内科
5)山形大学附属病院 第一内科 6)三重大学附属病院 循環器内科
7)弘前大学医学部附属病院 循環器内科 8)川崎幸病院 循環器内科
9)川崎幸病院 心臓血管外科
【背景】
左室内と上行大動脈の圧較差は、大動脈弁狭窄症の重症度やTAVI急性期手技成功、人工弁機能の指標として用いられている。この圧較差については、外科弁や経カテーテル的人工弁の実験モデルにおいて、簡易ベルヌーイ式を用いた心エコーによる計測値とカテーテルでの実測値の間に乖離が存在することが示されてきたが、実際のTAVI後の乖離については十分に評価されていない。
【方法】
2010年から2021年にかけて6施設でTAVIを行った2267例のうち、バルーン拡張型人工弁のSAPIENシリーズ、もしくは自己拡張型人工弁CoreValveシリーズを用いた症例から、外科弁機能不全の症例を除外した645例を対象とした。弁留置直後にカテーテルで測定した平均圧較差(Invasive mPG)と48時間以内に簡易ベルヌーイ式を用いて測定したエコーでの平均圧較差(Doppler mPG)の乖離を評価した。乖離が存在する場合、その主な原因と考えられる圧回復現象への補正を行い、急性期手技成功基準に対する圧乖離の影響を評価した。
【結果】
SAPIEN・CoreValveのいずれでもDoppler mPGのほうがInvasive mPGよりも有意に高く(SAPIEN: 5.5±2.7mmHg vs. 13.0±4.6mmHg, p<0.001, CoreValve: 6.2±3.1mmHg vs. 10.1±4.7mmHg, p<0.001)、特にSAPIENのほうがその乖離が大きかった(SAPIEN: 7.5±4.5mmHg vs. CoreValve: 3.9±4.7mmHg, p<0.001)。圧回復現象を補正したところ、Doppler mPGとInvasive mPGの差は小さくなり、CoreValveでは統計的な有意差がなくなった。TAVI後、45人(7.0%)のDoppler mPGが20mmHg以上であったが、圧回復現象の補正後はその数は10人(1.6%)まで減少した。
【結論】
TAVI後のエコーによる評価は人工弁圧較差を過大評価する可能性がある。その乖離は圧回復現象の補正で縮小できるが、補正後も残存した。弁機能不全の評価にはDoppler mPGだけでなく、臨床症状やCT所見、Invasive mPGなどを総合的に評価する必要がある。

Case Report Award
COVID-19 mRNAワクチン接種後の心筋炎に対して免疫抑制療法を行い奏功した2症例の検討
鮎澤祥吾,山本昌良,矢口拓実,田尻和子,家田真樹
筑波大学附属病院 循環器内科
【症例】
COVID-19 mRNAワクチン接種後の心筋炎に対して心筋生検を施行した2例について詳細な心筋病理所見を含めて報告する。症例1:18歳女性。ファイザー社製ワクチン1回目の接種後11日目に胸痛で受診。心筋逸脱酵素の上昇と高度の左室収縮能低下を認めた。血行動態が不安定でありIABPを挿入した。心筋病理ではリンパ球を中心とした著明な炎症細胞浸潤を認めた。ステロイドパルス療法が奏功し、2度目の心筋生検では炎症細胞浸潤の改善を認めた。症例2:18歳男性。モデルナ社製ワクチン2回目の接種後3日目に胸痛が出現した。心筋逸脱酵素の軽度上昇と軽度の左室収縮能低下を認めた。心筋病理では炎症細胞浸潤はごく軽度であり、ステロイドによる免疫抑制療法により速やかに心筋炎の軽快を認めた。
【考察】
COVID-19 mRNAワクチン接種後に発症した心筋炎に対して心筋生検を施行し,real-time PCRによるウイルスゲノム検査および病理学的所見を得た。心筋病理所見ではCD8+Tリンパ球およびマクロファージを中心とした炎症細胞浸潤を認め,COVID-19 mRNAワクチン接種後の劇症型心筋炎に関する以前の症例報告の病理像と類似していた1)。ステロイドによる免疫抑制療法を試みたところ,両症例ともに心筋逸脱酵素の低下および心機能の改善を認め,臨床経過からは免疫抑制療法が奏功したと考えられた。ワクチン接種後心筋炎の機序は不明であるが,過去のウイルス性心筋炎,あるいは不顕性の自己免疫性心筋炎を有する症例がワクチン接種による免疫系へのアジュバント効果によって心筋炎が顕在化した可能性が示唆されている2,3)。両症例ともに心筋からウイルスゲノムは検出されず,自己免疫疾患の存在も否定的であり,心筋炎発症の機序は不明である。心筋症関連遺伝子異常の存在が急性心筋炎の発症リスクを上昇させる可能性が報告されており4),ワクチン関連心筋炎の発症機序に迫るべく,現在,遺伝子解析を行っている。
【参考文献】
- 1)
- Verma AK, Lavine KJ, Lin CY. Myocarditis after Covid-19 mRNA Vaccination. N Engl J Med. 2021 Sep 30;385(14):1332–34.
- 2)
- Caforio ALP. Receipt of mRNA Vaccine against Covid-19 and Myocarditis. N Engl J Med. 2021; 385: 2189–90
- 3)
- Caforio ALP, Baritussio A, Basso C, Marcolongo R. Annu Rev Med. 2021; 73: 149–66.
- 4)
- JACC Basic Transl Sci. 2021 Jul 26;6(7):584-592.
(症例1:入院時)

(症例1:退院時)