第261回関東甲信越地方会 受賞演題一覧(2021年9月6日~12日開催)
第261回関東甲信越地方会 最優秀賞受賞演題(2021年9月6日~12日開催)
Student Award
神経リンパ腫症に対する自家末梢血幹細胞移植直後に発症した心不全症例に対する検討と課題
吉田 有希1)、紺野 久美子2)、小山 修平2)、住吉 立3)、野村 高広2)、渡邊 雄介2)、田代 晴子3)、
横山 直之2)、上妻 謙2)
1)帝京大学医学部 医学科
2)帝京大学医学部内科学講座 循環器内科
3)帝京大学医学部内科学講座 血液内科
【症例】
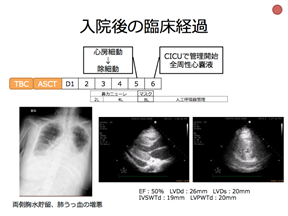
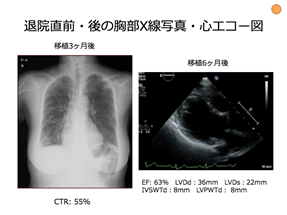
65歳の女性、顔面のしびれを主訴に脳神経内科を受診し、非全身性血管炎性ニューロパチーが疑われた。ステロイドパルス、免疫グロブリン大量点滴静注療法をおこなったが、症状の改善を認めなかった。PETで乳房に腫瘍集積を認め、針生検でびまん性大細胞型B細胞リンパ腫(DLBCL)と診断がつき、ニューロパチーは神経リンパ腫症によるものと考えた。DLBCLに対し自家末梢血幹細胞移植をおこなう方針とし、移植前にR-MPV療法、放射線治療、TBC療法(チオテパ、ブスルファン、シクロホスファミド)をおこなった。移植前の心電図、胸部X線写真、心エコー図は正常であった。移植3日後に心電図で洞性頻脈、低電位、Ⅱ、Ⅲ、aVF、V4、V5、V6でのST上昇、胸部X線写真で両側胸水貯留を認めた。移植4日後に胸水貯留の増悪、血液生化学検査でNT-proBNPは24、454pg/mL、トロポニンTは157 ng/Lと高値であり、心エコー図で心嚢液貯留、心室壁肥厚を認めた。心筋炎による心不全を疑い、利尿薬とβ遮断薬による治療を開始し、移植5日後に頻脈性心房細動を発症し、呼吸状態の悪化、胸水と心嚢液貯留、心室壁肥厚の増悪を認めた。心不全に対する集中治療の介入が必要と判断し、無菌室管理からCICUでの人工呼吸器を含めた全身管理へと変更した。頻脈性心房細動は除細動にて洞調律に回復、ACE阻害薬、抗アルドステロン薬の抗心不全薬の投与と全身管理により循環動態が安定し、移植14日後に循環器内科と併診とし血液内科に転科転棟とした。その後心不全の悪化を呈することなくDLBCLの治療経過も良好であり、移植84日目に退院した。移植6ヶ月後には心エコー図で心嚢液貯留、心室壁肥厚の著明な改善を認めた。
【考察】
シクロホスファミドによる心毒性の特徴的な病像に心電図で低電位とST変化、心嚢液貯留、心室壁肥厚、心筋炎がある。シクロホスファミド投与1-3週間後に心不全を発症する頻度は7-28%で、ハイリスク因子にアントラサイクリン系薬との併用、放射線治療、高齢者がある。本疾患の病因は不明であるが、シクロホスファミドが心内膜を障害する報告がある。本症例の症状はシクロホスファミドによる心毒性の病像と一致していることから、シクロホスファミドが誘因による頻脈性心房細動発症をきっかけに、急性心不全を引き起こしたと考えられる。
腫瘍治療による心毒性を引き起こす薬剤は他にも存在するが、心不全発症の予測の評価法はまだ確立していない。また、腫瘍治療の進歩により長期生存者のがんサバイバーが心疾患を合併するリスクも増大している。そのため腫瘍に関わる科と循環器が連携をはかり、心機能低下、心不全発症の際に腫瘍治療を継続するリスクとベネフィットを協議し治療方針を決定する必要がある。
シクロホスファミドによる急性心不全を発症したが、血液内科と循環器内科が連携し心不全の改善が得られた症例について報告した。
Resident Award
労作時息切れが急速に進行した、巨大肝内動静脈瘻を伴う遺伝性出血性末梢血管拡張症(HHT)の一例
川口 琴子、中山 幸輝、可児 邦広、八木 宏樹、武田 憲文、波多野 将、大門 雅夫、小室 一成
東京大学医学部附属病院 循環器内科
【症例】
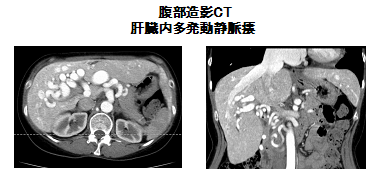
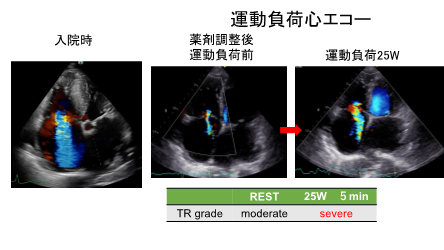
症例は52歳女性。31歳時の妊娠時に肝機能異常を指摘され、精査にて肝臓内血管奇形を伴う遺伝性出血性末梢血管拡張症(HHT)と診断された。33歳の第2子妊娠の後から動悸・下腿浮腫が出現し、初回心不全入院した。以降外来で内服加療されて安定していたが、数か月前から数十メートル程度の平地歩行で息切れが出現するようになり、精査加療目的に再入院となった。入院時の胸腹造影CT(図1)では、著明に拡張した腹腔動脈が蛇行しており、多発する肝内動静脈廔を認めたが以前と比較して、シャントサイズに著変なかった。経胸壁超音波検査で、軽度の左室拡大は認めるものの左室収縮能は良好であった。一方で、右心系は経時的に拡大し、弁輪拡大と軽度のtetheringによるTRがsevereに増悪(図2)していた。右心カテーテル検査では肺動脈楔入圧の上昇は認めず、前回入院時のような高拍出性の左心不全の病態とは異なることが分かった。心係数は5.1L/min/m2と保たれていたものの、上下大静脈の酸素飽和度から推定される肝動静脈廔へのシャント率は60%となり、肝臓以外への灌流量は1.8 L/min/m2と低下していることが分かり、組織低灌流になっていたと考えられた。心肺運動負荷試験でもpeak VO2が11.2 ml/min/kgと著明な運動耐用能の低下を認めた。
本症例の運動耐用能低下の原因としては、シャント血の盗血に加えて、長年の高拍出による弁輪拡大とtetheringによってTRが増悪し、心拍出量の相対的な低下を引き起こしたことが考えられた。今後のHHT治療に関しては肝移植が根本治療と考えられたが、ドナー候補がおらず困難であった。利尿剤の増量により息切れ症状の改善を認めたが、依然としてNYHA II以上が持続していた。今回、運動負荷心エコーを施行したところ、わずか50Wの負荷で継続困難となったが、負荷に伴うTRのさらなる悪化を認めた(図2)。内科治療抵抗性の心不全であり、三尖弁形成術の適応と考えられた。今後、適切なタイミングでの治療介入を検討している。
【考察】
HHTはTGFβ/BMPシグナルに関わる遺伝子変異を伴い、血管新生の異常で発症すると考えられている。常染色体優勢遺伝形式を呈し、有病率は約5000〜8000人に1人とされる。本症例は、HHTの中でもかなり巨大な肝内動静脈瘻による高拍出状態が持続していたが、TRの増悪に伴って顕著な運動耐用能低下を呈した。右心系の形態的な変化や、運動負荷による機能解析をもとに、三尖弁形成術の適応を評価することが出来たため報告する。
Clinical Research Award
若年者の心房細動発症における修正可能なリスク因子と生活習慣の関連―大規模疫学データベースからの検討―
松岡 聡志1)、2)、金子 英弘2)、3)、藤生 克仁2)、3)、伊東 秀崇2)、加門 辰也2)、桐山 皓行2)、
森田 光治良4)、道端 伸明5)、城 大祐5)、武田 憲文2)、森田啓行2)、中村 淳1)、康永 秀生4)、
小室 一成2)
1)新東京病院 心臓内科
2)東京大学医学部循環器内科
3)東京大学医学部先進循環器病学講座
4)東京大学医学部臨床疫学・経済学教室
5)東京大学大学院医学系研究科 ヘルスサービスリサーチ講座
【目的】
健診およびレセプトデータを集積したデータベースであるJMDC Claims Databaseを用いて若年者(20-39歳)を対象に心房細動発症における修正可能なリスク因子と生活習慣を明らかにする。
【方法および結果】
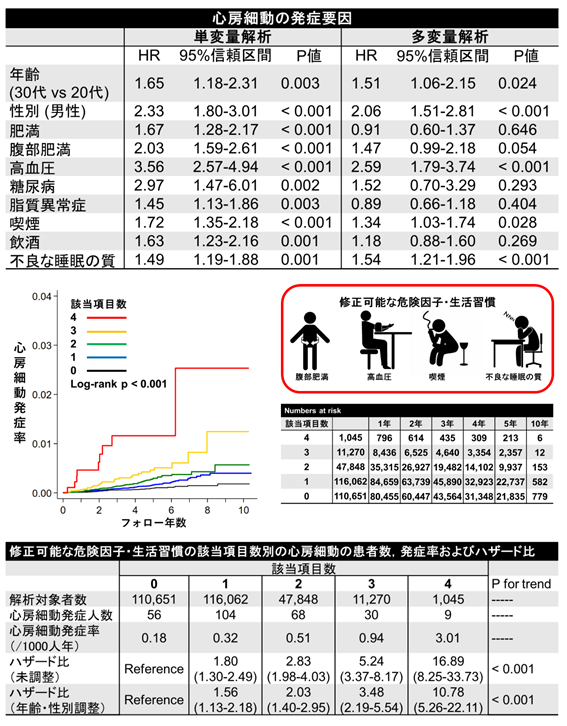
2005年1月から2018年8月までにJMDC Claims Databaseに登録された心血管疾患、甲状腺疾患の既往のない20-39歳の若年者286、876例(年齢中央値34歳、男性54.4%)を対象とした。平均観察期間1,017±836日の間に267例(0.1%)が心房細動を発症した(0.33/1000人年)。Cox回帰分析で年齢、性別、腹部肥満、高血圧、喫煙、不良な睡眠の質が心房細動発生と関連した.これらの因子のうち、修正可能な因子である腹部肥満、高血圧、喫煙、不良な睡眠の質の該当項目数で心房細動発症リスクを層別化すると、該当項目なしの場合と比較してハザード比は該当項目1項目 1.56、2項目 2.03、3項目 3.48、4項目 10.78と心房細動発症リスクは段階的に上昇した。
【結論】
JMDC Claims Databaseを用いて解析した結果、心血管疾患の既往のない若年者(20-39歳)の心房細動の発症には、腹部肥満、高血圧、喫煙、不良な睡眠の質が関連していた。これらの該当項目が多いほど、心房細動を発症するリスクが高いと考える必要がある。
Case Report Award
脳梗塞を契機に診断に至った僧帽弁輪部膿瘍によるAustrian症候群の1例
小野 亮平1)、梶山 貴嗣1)、深澤 万歓2)、松宮 護郎2)、小林 欣夫1)
1)千葉大学医学部附属病院 循環器内科
2)千葉大学医学部附属病院 心臓血管外科
【背景】
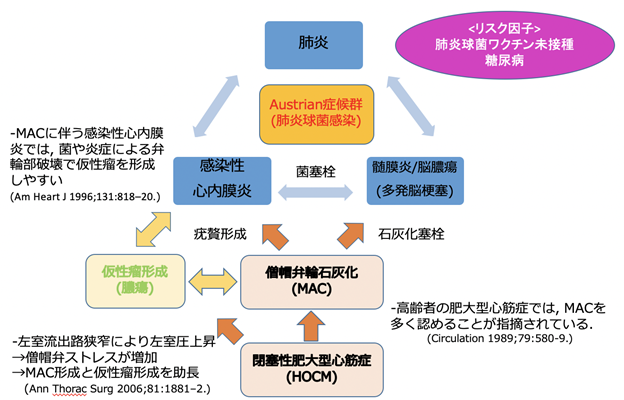
Austrian症候群とは、肺炎球菌による肺炎・感染性心内膜炎・髄膜炎を合併した稀な病態であり、その致死率は20-25%と高値であり予後不良と報告されている。
【症例】
症例は68歳女性。10年前に肥大型心筋症と診断されたが、特に症状はなくフォローはされていなかった。来院4日前より発熱、倦怠感、呼吸困難を自覚し前医を受診。精査の結果、肺炎及び尿路感染症の診断で入院となった。尿中肺炎球菌抗原が陽性であり肺炎球菌性肺炎が疑われセフトリアキソンで加療を開始。入院翌日に右上下肢麻痺・項部硬直があり頭部MRIで多発脳梗塞を認めた。その際に心房細動が指摘され、抗凝固薬を開始した。同日に血液培養からも肺炎球菌が検出され精査加療目的に当院へ転院依頼があり入院となった。既往に糖尿病があり、抜歯歴や肺炎球菌ワクチン接種歴はない。来院時の採血ではCRP 14.7mg/dLと著明な炎症反応高値を認めていた。経胸壁心エコーは閉塞性肥大型心筋症(HOCM)に矛盾しない所見であり僧帽弁輪石灰化(MAC)を認めていた。血栓評価目的で施行した造影CTでは心内血栓は認めず、MACに接して左房下面に僧帽弁輪部膿瘍が疑われた。経食道心エコーではMACに疣贅の付着と膿瘍腔を認めていた。以上から肺炎球菌菌血症に伴う肺炎・感染性心内膜炎・髄膜炎であり、僧帽弁輪部膿瘍によるAustrian症候群と診断した。2期的に外科的膿瘍切除、僧帽弁置換術、仮性瘤縫縮術を施行し、術後8週間の抗生剤加療後、第73病日に独歩退院した。
【考察】
Austrian症候群のリスクファクターは、アルコール多飲・糖尿病・臓器移植後・脾摘後などが挙げられ、本症例では糖尿病を満たすのみであった。ただし背景としてMACがあり、感染性心内膜炎リスクは高い状態であった。MACと脳梗塞の関連についてはMACから逸脱した石灰化粒自体や感染性心内膜炎による炎症の波及によりMACが破壊されて多発脳梗塞を起こすことが報告されている。本症例でAustrian症候群を来した機序としては、まずHOCMを背景として、左室流出路狭窄により左室圧が上昇した結果、僧帽弁ストレスが増大し、MAC形成と仮性瘤形成を助長したと考えられた。更にMACでは疣贅形成を来しやすく、MACに伴う感染性心内膜炎では、菌や炎症による弁輪部破壊で仮性瘤を形成しやすいことから両者も密接に関係があったと考察された。これまでにMACと僧帽弁輪部膿瘍に併発したAustrian症候群の報告はなく、非常に貴重な症例と考えられた。